Введение. Нарушение естественного мочеиспускания при нейрогенном мочевом пузыре и использование различных методов мочеотведения приводят к развитию инфекционно-воспалительных осложнений мочевыделительной системы [1]. Инфицирование мочевыводящих путей может быть вызвано различными грамотрицательными и грамположительными бактериальными агентами, обладающими способностью персистировать на их слизистых и инородных телах [2]. По данным микробиологических исследований у пациентов с позвоночно-спинномозговой травмой среди возбудителей инфекционно-воспалительных осложнений мочевыделительной системы преобладают E. coli, что связано с экспрессией различных факторов вирулентности микроорганизма, способствующими повышению адгезии к эпителиальным клеткам, в частности к микроворсинкам эпителия различных типов фимбрий (р-фимбрии) и др. [1 – 6].
Известно, что уропатогенные штаммы E. coli способны формировать биопленки (микроколонии) на слизистой оболочке мочевого пузыря и внутри эпителиальных клеток, однако E. coli обычно рассматривается как маловирулентный микроорганизм, входящий в состав нормальной микрофлоры кишечника [7]. В то же время способность бактерий формировать биопленку и как следствие – повышение их устойчивости к факторам окружающей среды, в том числе и к антибактериальным препаратам, по сравнению с планктонными микробными клетками создает серьезную проблему для медицинской практики [6, 8–10].
Цель исследования – изучить адгезивные свойства клинических штаммов E. coli, выделенных из мочи пациентов с позвоночно-спинномозговой травмой, и их способность формировать биопленки.
Материалы и методы. Проведено исследование адгезивных характеристик 9 штаммов E. coli, выделенных из образцов мочи 9 пациентов (4 женщины, 5 мужчин), находившихся на лечении в отделение нейрохирургии РНЦ ВТО с позвоночно-спинномозговой травмой, поздний период. Пробы мочи получали с помощью уретрального катетера. У 7 из 9 пациентов E. coli определялась в ассоциации со Staphylococcus epidermidis, Staphylococcus saprophyticus, метициллин-резистентными штаммами Staphylococcus haemolyticus, Enterococcus faecalis, Enterobacter spр.
Возраст пациентов составил от 21 года до 54 лет (в среднем 31,1±9,7), давность заболевания — от 2 до 12 лет.
 Нейрогенные нарушения мочеиспускания (затруднение —1, недержание — 4, задержка — 1, спинальный автоматизм —3), наблюдавшиеся у пациентов, были результатом травмы позвоночника в шейном (4 пациента), грудном (2) и грудопоясничном (3) отделах.
Нейрогенные нарушения мочеиспускания (затруднение —1, недержание — 4, задержка — 1, спинальный автоматизм —3), наблюдавшиеся у пациентов, были результатом травмы позвоночника в шейном (4 пациента), грудном (2) и грудопоясничном (3) отделах.
У 1 пациента дренирование мочевого пузыря осуществлялось посредством эпицистостомы, у 4 — уретральным катетером, остальные использовали подгузники и уропрезервативы.
Двигательные нарушения в виде верхнего парапареза, нижней параплегии отмечены у 3 пациентов; нижней параплегии — у 5; нижнего парапареза — у 1. У всех пациентов выявлены нарушения чувствительности различной степени.
Выделение чистой культуры штаммов E. coli проводили общепринятыми методами. Идентификацию исследуемых штаммов проводили на бактериологическом анализаторе WalkAway-40 Plus («Siemens», США), используя панели РВСРС 20.
Адгезивную активность штаммов изучали на модели эритроцитов человека А (ІI) по методике В.И. Брилиса [11]. Исследование проводили под световым микроскопом, учитывая в общей сложности не менее 50 эритроцитов. Микроорганизмы считали неадгезивными при индексе адгезивности микроорганизмов (ИАМ) до 1,75; низкоадгезивными — от 1,76 до 2,5; среднеадгезивными — от 2,51 до 4; высокоадгезивными — 4,1 и выше.
Исследование способности E. coli формировать биопленки на поверхности 96-луночных полистироловых пластиковых планшетов проводили по методу G. Toole и R. Kolter [12]. По уровню адсорбции красителя этанолом, измеренному в единицах оптической плотности (OD630) на фотометре ELx808 («BioTek», США) при длине волны 630 нм, оценивали активность формирования биопленки. Для интерпретации полученных данных определяли критерии способности штаммами формировать биопленки в соответствии с рекомендациями [13].
Для визуальной и количественной оценки способности бактерий формировать биопленки на поверхности покровного стекла использовали стерильные стеклянные чашки Петри диаметром 100 мм. В каждую чашку помещали стерильное покровное стекло размером 24х24 мм, на поверхность которого осторожно наливали 200 мкл суточной культуры E. coli и помещали в термостат при 37oС. Через 3 ч добавляли мясопептонный бульон до 2 мл и помещали в термостат при 37oС. Через 24 и 48 ч после инкубации питательную среду сливали, поверхность стекол трижды промывали 1,15М фосфатным буфером, фиксировали 96o-ным спиртом, высушивали, окрашивали раствором генциан виолета в течение 2 мин при комнатной температуре, после чего промывали фосфатным буфером.
Полученные препараты исследовали под микроскопом при увеличении в 640 раз (об. 40; ок. 16). Цифровые изображения полей зрения получали с помощью видеокамеры Scope Tec DСМ 300. Для определения количественных характеристик использовали программу ImageJ (США). С каждого препарата вводили не менее 20 полей зрения. На цифровых изображениях препаратов измеряли площадь поля зрения, количество и площадь, занимаемую единичными адгезированными клетками и микроколониями. Рассчитывали количество единичных адгезированных клеток и микроколоний на единицу площади (1мм2), и доли, занимаемые ими в площади поля зрения. При этом учитывали размер микроколоний: до 10 мкм2, от 10 до 100 мкм2, от 100 до 1000 мкм2, от 1000 до 10000 мкм2, более 10000 мкм2.
Статистическую обработку данных исследования выполняли с помощью табличного редактора Microsoft Excel-2010 и программного обеспечения анализа данных AtteStat Версия 13.0 [14]. Цифровые данные представлены в виде среднего арифметического значения и стандартного отклонения (M±SD). Для оценки статистической значимости различий между группами использовали критерий Вилкоксона. Различия между группами считали значимыми при р<0,05.
 Для оценки тесноты и направления связи между количеством и площадью (долями), занимаемой единичными клетками и микроколониями, и оптическими плотностями (OD630) рассчитывали коэффициент корреляционного отношения Пирсона.
Для оценки тесноты и направления связи между количеством и площадью (долями), занимаемой единичными клетками и микроколониями, и оптическими плотностями (OD630) рассчитывали коэффициент корреляционного отношения Пирсона.
Результаты. При анализе взаимодействия исследуемых штаммов микроорганизмов с эритроцитами установлено, что 8 из 9 штаммов характеризовались низкоадгезивными свойствами и только 1 штамм — среднеадгезивными.
Анализ результатов фотометрического исследования показал, что через 24 ч 7 из 9 штаммов обладали слабой, 1 — средней и 1 — высокой способностью к образованию биопленки. Через 48 ч только у 4 штаммов сохранялась низкая способность к образованию биопленки, из них у 2 наблюдали увеличение показателя по сравнению с предыдущим сроком наблюдения. Остальные штаммы обладали средней способностью к образованию биопленки.
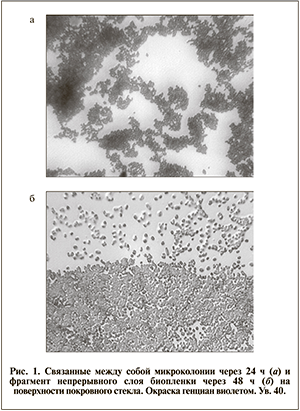
При визуальном исследовании препаратов на покровном стекле установлено, что единичные адгезированные клетки и микроколонии располагались на поверхности неравномерно. Два штамма, которые обладали средней и высокой способностью к образованию биопленки на полистироле, через 24 часа на поверхности стекла формировали связанные между собой микроколонии, которые через 48 ч были представлены непрерывным слоем, занимающим 2–3 поля зрения (рис. 1). В остальных случаях связанные между собой колонии определялись только через 48 ч.
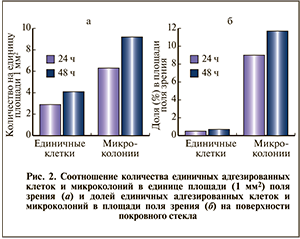
При количественной оценке способности бактерий формировать биопленки на поверхности покровного стекла установлено, что через 24 ч количество микроколоний на единицу площади было в 2,5 раза больше числа единичных адгезированных клеток (рис. 2, а). При этом преобладали микроколонии, размер которых не превышал 10 мкм2. Через 48 ч количество единичных адгезированных клеток и микроколоний увеличивалось соответственно в 2,5 и 1,5 раза по сравнению с предыдущим сроком наблюдения.
Через 24 и 48 ч на поверхности покровного стекла доля микроколоний в поле зрения более чем в 20 раз превышала площадь, занимаемую единичными адгезированными клетками (рис. 2, б). Большая часть площади поля зрения через 24 ч приходилась на микроколонии размером до 10 мкм2, а через 48 ч — на микроколонии размером от 100 до 1000 мкм2. Значимых различий между показателями не установлено, что может быть связано с небольшим числом наблюдений.
В то же время между изучаемыми показателями обнаружен ряд достоверных корреляционных связей. Так, через 24 ч коэффициент корреляции между OD630 и количеством, OD630 и долей микроколоний размером от 10 до 10000 мкм2 изменялся от 0,79 до 0,9. Через 48 ч установлена прямая корреляционная связь между OD630 и количеством (r = 0,73, p = 0,025), OD630 и долей (r = 0,81, p = 0,009) микроколоний размером от 1000 до 10000 мкм2.
Обсуждение. В развитии инфекционно-воспалительных осложнений мочевыделительной системы у пациентов с нейрогенными расстройствами мочеиспускания большое значение имеет образование биопленки на поверхности искусственных устройств (катетерах и др.), при производстве которых используются различные по физическим и химическим характеристикам материалы и покрытия [6, 15, 16].
В результате неспецифической адгезии микроорганизмы способны связываться с поверхностями медицинских устройств, особенность которых состоит в том, что у них полностью отсутствуют факторы, противодействующие адгезии, делающие ее практически неизбежной [15].
Проведенное нами исследование показало, что клинические штаммы E. coli, обладая низкой адгезивной активностью, способны образовывать биопленки на гидрофобных (полистирол) и гидрофильных (покровное стекло) поверхностях.
Несмотря на определенные успехи в лечении больных инфекционно-воспалительными осложнениями мочевыделительной системы, активных антимикробных препаратов, действующих на микроорганизмы в биопленках, до сих пор не существует. При этом необходимо учитывать, что биопленки на поверхности уроэпителия легче поддаются эрадикации антимикробными агентами по сравнению с биопленками, которые образуются на чужеродных объектах, находящихся в мочевыводящих путях [17, 18].
Заключение. Полученные результаты показали разную способность клинических штаммов E. сoli, выделенных из мочи пациентов с позвоночно-спинномозговой травмой, к формированию биопленки. У изученных штаммов, обладающих преимущественно низкими адгезивными свойствами, увеличивалась способность к образованию биопленки через 48 ч на поверхности как лунок полистироловых пластиковых планшет, так и покровного стекла. Учитывая, что развитие и персистенция инфекции зависят от размера и интенсивности роста микробной колонии, полученные нами результаты позволяют предположить возможность более выраженного образования биопленки в дальнейшем.
В связи с этим при лечении инфекционно-воспалительных осложнений мочевыделительной системы у пациентов с позвоночно-спинномозговой травмой в первую очередь должны проводиться мероприятия, предупреждающие образование биопленки на поверхности устройств мочеотведения, а при выборе антибактериальных препаратов необходимо учитывать их способность проникать внутрь биопленок и персистентный потенциал выделенных возбудителей.


