Введение. Лечение пациентов с позвоночно-спинномозговой травмой продолжает оставаться одной из труднейших задач современной медицины [1]. Одним из основных осложнений данной патологии служит нарушение функции мочевыделительной системы.
Потребность в системном подходе при исследовании мочевыделительной системы больных с позвоночно-спинномозговой травмой, отмечаемая некоторыми исследователями, остается по-прежнему нереализованной [2–7]. В клинической практике и научных публикациях отсутствует комплексный анализ состояния функции почек у данной категории больных. Относительно мало работ, в которых проводят анализ структурно-функциональных особенностей мочевыделительной системы с помощью экскреторной урографии [8–11], что не дает возможности комплексно оценить состояние этих больных и планировать лечебно-реабилитационный процесс в полном объеме.
Кроме того, проводимые биохимические исследования больных с позвоночно-спинномозговой травмой имеют разрозненный характер. Отдельно эпизодически рассматривается экскреция кальция, натрия, магния [12–15]. Большая часть работ посвящена вопросу клиренса креатинина, концентрации креатинина в крови и моче, протеинурии [3, 5, 16–18]. Однако многие авторы считают, что контроль уровня креатинина недостаточно информативен при позвоночно-спинномозговой травме и в прогнозировании повреждения функции почки, так как характер его изменений неоднозначен [3, 5, 16, 18].
Целью настоящей работы было комплексное исследование функционального состояния почек у больных с позвоночно-спинномозговой травмой.
Материал и методы. Работа основана на анализе результатов обследования 59 больных (47 мужчин и 12 женщин) с позвоночно-спинномозговой травмой в возрасте от 17 до 67 лет (в среднем 34,0±1,6 года). По уровню повреждения позвоночника больные были распределены на три группы. Первую (n=32) составили пациенты с травмой позвоночника в шейном отделе, вторую (n=11) – в грудном, третью (n=32) группу – в грудопоясничном отделе. В соответствии с классификацией травматической болезни спинного мозга О. А. Амелиной (1995) [19] в остром и раннем периодах болезни было 20 больных, в промежуточном и позднем – 39.

Нарушения функции тазовых органов были диагностированы у всех обследованных и проявлялись в виде задержки (18 больных), недержания мочи (20), затруднения мочеиспускания (4), спинального автоматизма (17). Нейрогенный мочевой пузырь констатировали в 100% случаев. При задержке мочи дренирование мочевого пузыря выполняли с помощью уретрального катетера (15 больных) или эпицистостомы (5). При недержании мочи больные использовали уропрезерватив (10 больных), подгузник (10). При спинальном автоматизме и затрудненном мочеиспускании отхождение мочи осуществлено через естественные мочевыводящие пути (19 больных).
Экскреторную урографию выполняли на рентгеновской установке CLINOMAT (Pixel HF-650, «Italray», Италия). Исследование начинали с обзорного снимка обеих почек и мочеточников, мочевого пузыря в горизонтальном положении больного на спине. Кассету размером 30х40 см устанавливали таким образом, чтобы нижний край ее совпал с верхним лонного сочленения. Рентгенологическое исследование выполнено на 7-й, 15, 30 и 60-й минутах после введения в локтевую вену 40 мл 76%-ного раствора тразографа («J. B. Chemicals & Pharmaceuticals Ltd», Индия) или 40 мл омнипака 300 («GE Health care Ireland», Ирландия). В качестве контрольной группы были обследованы 10 пациентов (5 мужчин и 5 женщин) в возрасте от 18 до 36 лет (в среднем 23,8±1,7 года), у которых не было выявлено патологических изменений в мочевыделительной системе.
Проведены биохимические исследования сыворотки крови и суточной мочи. Концентрацию мочевины, креатинина, мочевой кислоты, кальция, магния и неорганического фосфата определяли на биохимическом автоматическом анализаторе Hitachi/BM 902 (Италия) с использованием наборов реагентов фирмы «VitalDiagnostic» (Россия). Содержание натрия, калия и хлоридов оценивали ионселективным методом на ионселективном блоке биохимического анализатора Hitachi/BM 902 (Италия).
Кроме того, определяли: 1) клиренс метаболитов и электролитов путем деления концентрации вещества в суточной моче на его концентрацию в крови; 2) скорость клубочковой фильтрации (СКФ = [креатининмоча/креатининкровь] минутный объем мочи); 3) скорость экскреции кальция (отношение уровня кальция в суточной моче к уровню в ней креатинина); 4) осмоляльность мочи (ОСМ=2 ([Na]+[K])+[мочевина]) [20]; 5) соотношение К/Na в моче, рост которого коррелирует с активностью глюкокортикоидов, в частности альдостерона [21].
В качестве нормы использовали результаты биохимических исследований сыворотки крови и суточной мочи 20 практически здоровых людей обоего пола в возрасте от 20 до 40 лет.
Статистическую обработку данных проводили с помощью пакета анализа данных Microsoft EXСEL-2007. Для оценки достоверности различия средних использованы t-критерий Стьюдента и дополнительно (в случае малочисленности выборок) – непараметрический критерий Манна–Уитни, W-критерий Вилкоксона для независимых и сопряженных вариантов.
Принятый уровень значимости – 0,05.
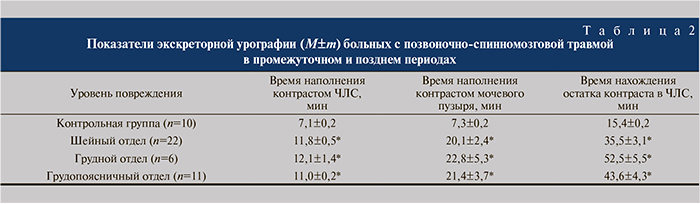
Результаты. Анализ результатов исследования мочевыделительной системы с помощью экскреторной урографии выявил снижение накопительной и выделительной функции почек (табл. 1, 2). Вне зависимости от уровня повреждения позвоночника и этапа развития травматической болезни время наполнения контрастом ЧЛС больных было больше, чем в контрольной группе (в среднем на 57,2±4,8%, р<0,05).
Время заполнения контрастом мочевого пузыря в острый и ранний периоды позвоночно-спинномозговой травмы были больше нормы в среднем на 114,3±6,8% (р<0,05), в промежуточный и поздний периоды – на 205,7±11,4% (р<0,05; см. табл. 1, 2). Следует заметить, что данный показатель не зависел от уровня повреждения позвоночника. Время нахождения остатка контраста в ЧЛС в остром и раннем периодах было больше, чем в контроле, в среднем на 187,3±5,8% (р<0,01), в промежуточном и позднем — на 192,5±8,6% (р<0,01). Значения этого показателя также не зависели ни от уровня повреждения, ни от этапа развития травматической болезни спинного мозга.
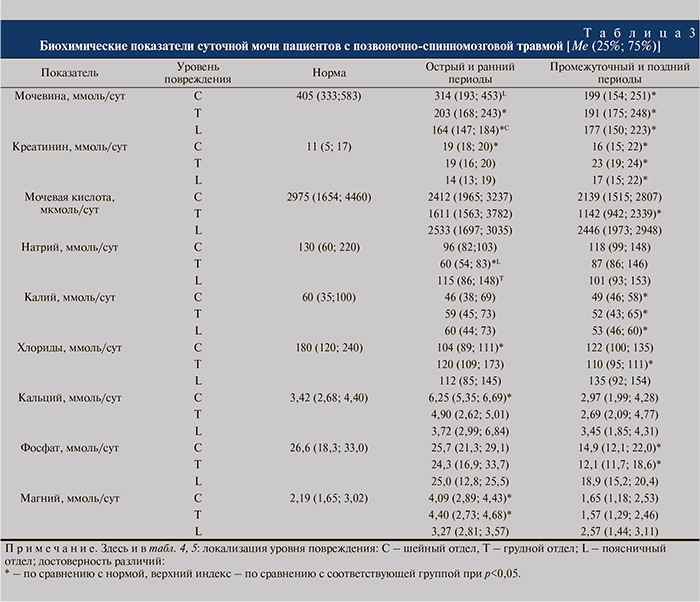
По результатам биохимических исследований сыворотки крови и суточной мочи (табл. 3) установлено, что в остром и позднем периодах позвоночно-спинномозговой травмы у всех пациентов было статистически значимое снижение суточной экскреции мочевины. При этом наиболее выраженное падение данного показателя было отмечено у пострадавших с травмой поясничного отдела, наименьшее – у пациентов с переломами шейных позвонков. Кроме того, важно отметить, что концентрация мочевины в моче пациентов всех групп в позднем периоде была меньше, чем в остром. Суточная экскреция креатинина в остром периоде была значимо увеличена у пациентов с травмой шейного отдела, в позднем – грудного отдела. Содержание мочевой кислоты в суточной моче пациентов всех групп на сроках наблюдения имело выраженную тенденцию к снижению. Наиболее ярко она проявлялась у пациентов с травмой грудного отдела.
Изменения суточной экскреции натрия в группах были незначительными. Достоверное снижение экскреции данного электролита имело место у пациентов в остром периоде травмы грудного отдела.
Содержание калия в суточной моче было ниже нормы в позднем периоде у пациентов всех групп. Кроме того, определена выраженная тенденция к снижению экскреции хлоридов и фосфатов с мочой пациентов всех групп. В отличие от других метаболитов экскреция кальция и магния у всех обследованных пациентов в остром периоде проявляла тенденцию к увеличению. Так, практически вдвое была увеличена концентрация кальция и магния (на 83 и 87% соответственно, р<0,05) в моче пациентов с травмой шейного отдела. Достоверного роста содержания кальция в моче пациентов с травмой грудного отдела в остром периоде не отмечено, однако у пациентов данной группы была значимо увеличена концентрация магния в суточной моче.
При расчете клиренса электролитов и метаболитов азотистого обмена установлено, что клиренс мочевины достоверно уменьшен относительно нормы в остром периоде у пострадавших с травмой грудного и поясничного отделов, а в позднем был снижен у пациентов всех групп (табл. 4).
Клиренс мочевой кислоты на всех этапах развития травматической болезни был самым низким у пациентов с травмой грудного отдела относительно как нормы, так и пациентов других групп.
Достоверного изменения клиренса калия у пациентов всех групп на сроках наблюдения не происходило. Статистически значимое снижение клиренса натрия было отмечено у пациентов с травмой грудного отдела в остром периоде.
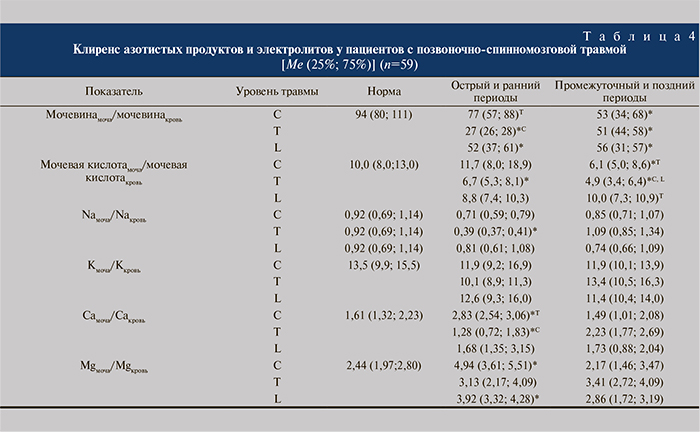
Клиренс кальция в острый период травматической болезни был достоверно выше относительно нормы у пациентов с травмой шейного отдела, тогда как у пациентов с переломами позвонков грудного отдела данный показатель был значительно ниже нормы. В поздний период средние показатели клиренса кальция у всех пациентов не имели статистически значимых отличий.
В остром периоде у пациентов всех групп также была определена тенденция к росту клиренса магния, достоверное увеличение данного показателя было зарегистрировано у пациентов с переломами шейного и поясничного отделов.
Анализируя полученные данные, необходимо обратить внимание на следующие факты: 1) у пациентов с позвоночно-спинномозговой травмой в посттравматическом периоде происходило снижение клиренса азотистых компонентов, которое сохранялось длительное время, а наиболее существенное снижение было отмечено у пациентов с травмой грудного отдела; 2) клиренс минеральных компонентов, наоборот, увеличивался, но только в остром периоде.
Далее нами было определено, что СКФ у пациентов всех групп в остром и позднем периодах позвоночно-спинномозговой травмы была достоверно повышена относительно нормы на 24–135%, в среднем – на 79,5±14,0% (табл. 5).
Скорость экскреции кальция, оцениваемая по коэффициенту Са/креатинин, была значительно снижена в остром периоде у пациентов с травмой грудного и поясничного отделов. В позднем периоде данный показатель был достоверно (практически вдвое) ниже нормы у пациентов всех групп. При этом осмоляльность мочи у всех пациентов имела выраженную тенденцию к снижению в остром и позднем периодах, значимые изменения были зарегистрированы у пациентов с травмой грудного отдела в остром периоде.
Увеличение соотношения К/Na в моче определяло предпочтительную экскрецию калия на фоне задержки натрия, что вызвано известным влиянием на экскрецию натрия альдостерона [21], а значит, свидетельствовало об увеличении у обследованных пациентов стимулирующей роли данного гормона на экскрецию электролитов. При этом если у пациентов с травмой шейного и грудного отделов достоверное увеличение соотношения К/Na наблюдалось в остром периоде, то у пациентов с поясничной локализацией повреждения – в позднем периоде.
Обсуждение. Как свидетельствуют данные литературы, в настоящее время по-прежнему не определены рекомендации по скринингу мочевыделительной системы больных с позвоночно-спинномозговой травмой [11]. Не уделено должного внимания оценке функции почки с помощью экскреторной урографии [22], в различных работах данную методику используют при анализе структурных изменений в сравнительном аспекте с другими методами (УЗИ) [8, 9]. Необоснованный отказ от использования экскреторной урографии способен приводить к потере до 50% важной диагностической информации [23].
Анализ результатов наших исследований мочевыделительной системы больных с позвоночно-спинномозговой травмой при помощи экскреторной урографии показал, что независимо от уровня повреждения и периода травматической болезни было определено снижение накопительной и выделительной функций почек. Данные факты свидетельствуют, по всей видимости, о характерных адаптационно-компенсаторных изменениях функции почек, возникающих вследствие застойных явлений в полостных структурах мочевыделительной системы.

Параллельно с этими изменениями имело место увеличение СКФ также независимо от уровня повреждения и периода травматической болезни. Полученные нами данные согласуются с результатами, полученными W. Klingensmith и соавт. [2], которые использовали ренографию (Tc99m MAG3) для оценки СКФ и тубулярной секреции. По мнению этих авторов, почечный клиренс (измеряемый с помощью Tc99m MAG3) значительно возрастает в течение первых двух лет после травмы, а затем падает и эти изменения более выражены у больных тетраплегией по сравнению с параплегией. По данным других исследователей, более значительные изменения функции почек в данной популяции больных имели место у женщин и пожилых людей [24, 25].
Проведенные нами биохимические исследования выявили определенную закономерность: в остром периоде позвоночно-спинномозговой травмы наиболее выраженные нарушения экскреторной функции почек были зарегистрированы у пациентов с травмой шейного и грудного отделов, в позднем периоде – только грудного. У пациентов с травмой поясничного отдела эти изменения были наименьшими. При этом если у пациентов с шейной локализацией перелома к позднему периоду наблюдали частичное восстановление отдельных биохимических показателей относительно нормы, то у пациентов с переломами грудных и поясничных позвонков выраженность изменений нарастала.
Причина описанных выше изменений, на наш взгляд, одна – нарушение нейрогуморальной регуляции почечной функции, интенсивность которой зависела от локализации перелома. В частности, в зависимости от уровня позвоночно-спинномозговой травмы патогенез нарушений функции почек может быть связан с: 1) повреждениями различных структур спинного мозга, которые определяют иннервацию почек и сосудов; 2) нарушениями гуморальной регуляции, вызванными стимуляцией гипоталамо-гипофизарно-адренокортикальной системы в результате шока на фоне прямого повреждения или нарушения иннервации эндокринных органов.
Выводы
- У больных с позвоночно-спинномозговой травмой независимо от уровня повреждения и периода травматической болезни накопительная и выделительная функции почек значительно снижены, а скорость клубочковой фильтрации увеличена.
- Изменения экскреторной функции почек у больных с позвоночно-спинномозговой травмой проявлялись снижением клиренса азотистых компонентов, увеличением в остром периоде клиренса минеральных компонентов, снижением скорости экскреции кальция.
- Позвоночно-спинномозговая травма способствует увеличению стимулирующего влияния альдостерона на функцию дистальных канальцев нефронов почки – повышение экскреции калия с мочой. При травме шейного и грудного отделов позвоночника достоверное увеличение коэффициента К/Na было в остром периоде позвоночно-спинномозговой травмы, у пациентов с поясничной локализацией повреждения – в позднем.


